
Mitral Valve Surgery in a Patient 50 Years after a Pneumonectomy
一名患者在肺切除术后50年接受了二尖瓣手术
von Oehsen et al.
**中文内容仅供参考,一切以英文原文为准。
肺切除术主要用于治疗中央型肺癌。然而,手术后的存活率受到肿瘤侵袭性的限制。在上个世纪,当肺切除术被广泛地用于治疗肺结核等疾病时,长期存活的患者很常见。长期并发症包括肺动脉高压、肺功能减退和心衰,这可能是由于心轴异常所致。有关肺切除术后数十年患者长期心衰的报道十分罕见。虽然心脏手术和再手术是有必要的,但鉴于解剖条件的挑战性,且患者的临床状态不佳,因此处理起来非常复杂。
本病例首次报告了这样一位患者,其因心衰反复发作,在进行肺切除术后又接受了三次心脏瓣膜手术。此外还介绍了治疗策略和手术技巧。
病例描述
患者于 1964 年被诊断出患有恶性睾丸肿瘤,于是进行了单侧睾丸切除术。1968 年,发现左侧肺转移,由于肿瘤范围较大,进行了肺切除术,术后恢复良好。进一步的肿瘤随访显示,恶性肿瘤没有复发,术后肺功能保持稳定。
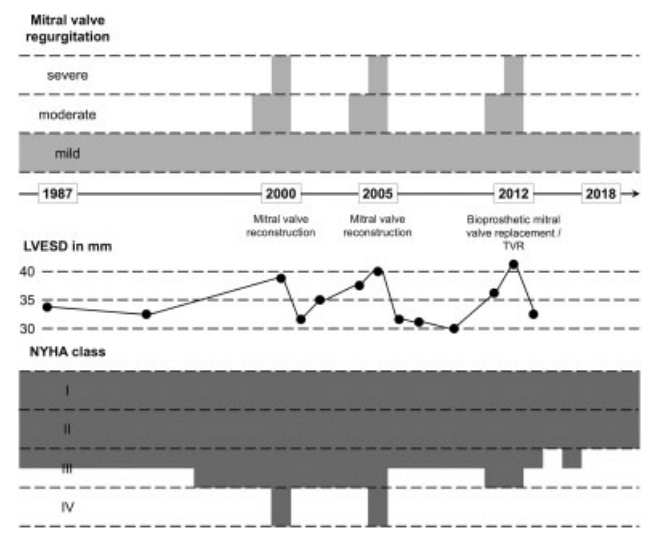
图1. 从1987年到2018年的时间概述。患者于 1968 年接受了肺切除术。1987 年,由于二尖瓣反流加剧,患者首次出现临床症状。2000年和2005年,患者接受了二尖瓣重建手术。2012 年,患者同时接受了二尖瓣生物瓣膜置换术和三尖瓣重建。左心室收缩末期直径随时间变化表明与反流相关。
从 1987 年开始观察到患者二尖瓣反流加重(图 1)。尽管接受了最佳的药物治疗,但随着时间的推移,患者的身体状况却越来越差(达到NYHA IV级)。2000 年,临床症状加重,出现了肺水肿。超声心动图显示二尖瓣前叶脱垂导致的严重二尖瓣反流,但左心室收缩功能保留。为了评估术前风险,患者接受了大量的心肺功能检查,最大摄氧量为 13 mL O2/kg/min。对该病例进行了讨论,患者具有手术指征。手术采用胸骨正中切口和标准插管来进行体外循环和心脏停搏,然后进行了二尖瓣重建,并使用人工腱索修复了二尖瓣前叶脱垂,最后植入了一个瓣环。
二尖瓣反流第二次出现。患者新发房颤,需要服用抗心律失常药物并进行心脏复律。2005 年,在患者出现严重心衰症状(NYHA IV 级)的情况下,再次诊断出二尖瓣反流。最大摄氧量(13 mL O2/kg/min)和其他心肺功能检查符合手术指征。手术采用胸骨正中切口,重新进行了二尖瓣重建并植入了人工腱索,通过单极高频电流对左心房进行了消融,但是二尖瓣环后部由于降主动脉而出现变形。
术后发现轻度残余反流,左心室收缩期容积缩小。患者的身体状况有所改善(NYHA II/III级)。反复发作的房颤得到了药物和心脏复律治疗。最后,患者恢复了长期窦性心律。
自 2011 年起,患者临床症状逐渐复发。2012 年,患者出现严重的二尖瓣反流,左心室轻度增大。此外,还观察到中度三尖瓣反流和永久性房颤。除了基本的心肺功能检查外,由于患者的临床状况不佳,此次采用6 分钟步行实验来替代全面的运动实验。患者肺功能正常,额外供氧的原因是心功能不全。鉴于以下几点:(1)除心脏外,患者其他功能均可接受;(2)患者无其他相关并发症;(3)患者在之前三次开胸手术后恢复良好,作者认为患者应合并二尖瓣和三尖瓣重建手术。
在随后的重复手术(经胸骨正中切口)中,由于无法对二尖瓣前叶的瓣叶进行重构,于是进行了二尖瓣生物瓣膜置换术,并缩小了三尖瓣环。在手术过程中,妥当处理了粘连和胸部切除术后的心轴异常。术后患者肺炎,需要静脉注射抗生素,转入ICU。患者恢复良好,由于存在永久性房颤,于是植入了心脏起搏器,需要暂时增加 1 升/分钟的供氧量。
2015 年,发生了生物二尖瓣膜导致的心内膜炎。这可能与口腔治疗以及标准预防性治疗的抗生素耐药性有关。调整抗生素后,炎症有所缓解。
在最近一次心脏手术的六年后,也就是肺切除术的 50 年后,只出现了轻微的二尖瓣反流,没有三尖瓣反流,出现的轻度肺动脉高压也无需治疗。患者身体状况良好(NYHA II 级),无需额外供氧。
评论
有人于 1995 年报道了第一例肺切除术后瓣膜置换术。一位患者因支气管类癌而接受右侧肺切除术,10 年后接受了二尖瓣置换术。也有病例显示,右侧肺切除术与二尖瓣置换术之间的间隔时间长达 41 年,是迄今为止间隔时间最长的病例。目前仅有 18 篇关于肺切除术后瓣膜重建或置换的报道,还没有关于肺切除术后进行两次心脏瓣膜手术的病例报告。
迄今为止,有详细的综述评估了19名在接受过肺切除术后接受冠状动脉旁路移植或心脏瓣膜手术的患者。在研究期间的40年里,仅进行过一次二尖瓣重建术和四次瓣膜置换术。当时,所有肺切除术后的开胸手术都属于高风险手术,因为术后并发症的风险高达50%,总死亡率为16%。
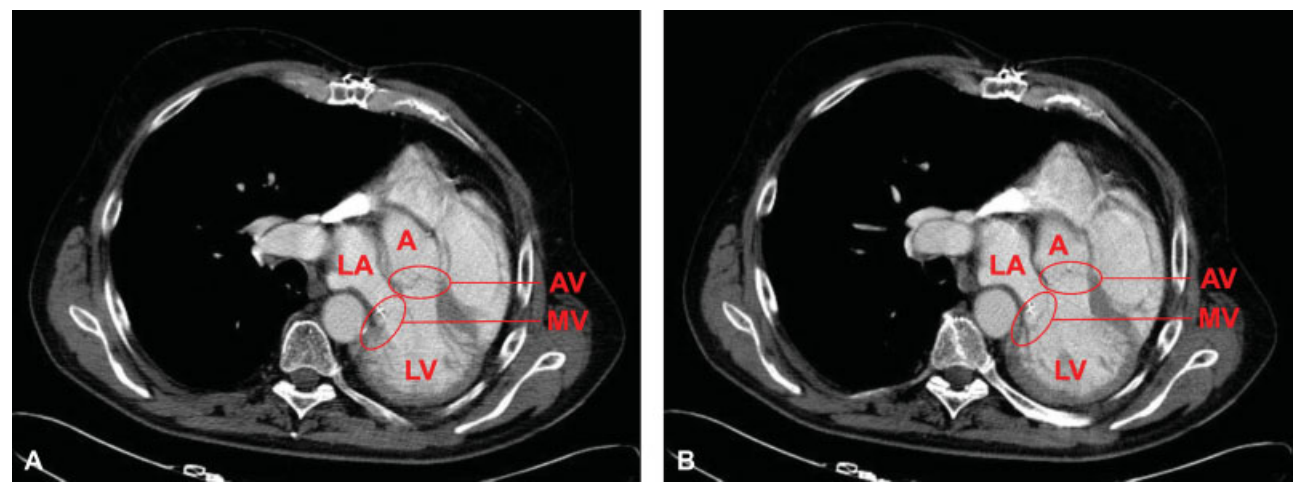
图2. 2006 年第二次二尖瓣重建手术后的胸部术前CT图。左肺切除术后,心脏在胸腔左侧内旋转移位。由于纵隔移位,胸骨正中切开术为暴露二尖瓣的最佳位置提供了可能。
肺切除术后的开胸手术属于高风险手术,因为患者会出现纵隔移位(图 2)。这就导致了异常的解剖条件,往往会使包括介入在内的手术变得困难。一般来说,边缘对边缘的MitraClip术和用于减少瓣环扩张的新策略(如 Carillion术)可用于经导管二尖瓣修复术。此外,最近还开发出了几种经导管二尖瓣置换系统(如 Tendyne术)。然而,迄今为止,还没有关于肺切除术后介入性二尖瓣重建或置换的病例。这可能是由于心脏位置的改变,使得在正确位置植入介入装置变得复杂。因此,虽然手术很困难,但结果往往更可预测。出于同样的原因,在本病例中,作者排除了介入治疗方案。
大多数心脏瓣膜手术都是在右侧肺切除术后进行的。肺切除术对心脏位置的长期影响主要表现在左侧肺切除术后心脏的旋转移位。手术策略必须考虑以下几点:纵隔明显扭曲导致的异常解剖结构,心脏向左侧完全移位导致的降主动脉对左心房的压迫,建立体外循环的插管选择,目标区域的暴露。尤其是在进行右侧肺切除术后,应考虑采用微创方法对二尖瓣进行手术。最合适的手术方法应在做完心脏CT后再进行确定。在本病例中,由于心脏旋转到左胸,胸骨正中切开术提供了完美的二尖瓣暴露。目前还不清楚降主动脉和二尖瓣之间可能存在的干扰是否导致二尖瓣环变形。这可能是二尖瓣反流复发的原因之一。
二尖瓣前叶脱垂是导致二尖瓣反流的主要机制。在本病例中,患者2000 年通过腱索置换术和植入瓣环成形术纠正了脱垂。术中评估显示二尖瓣反流的复发是由二尖瓣前叶脱垂复发引起的,因此 2005 年再次进行了手术。二尖瓣环的大小仍然正常,但是由于二尖瓣环后部与降主动脉的关系密切,二尖瓣环后部似乎发生了变形。在心脏停搏的情况下,在使用额外的腱索置换使得瓣膜有良好结构之后,二尖瓣前叶脱垂被再次纠正。这一过程凸显了使用新腱索重新修复前叶的难度。总结在这个病例中,降主动脉对二尖瓣膜瓣环结构改变的影响可能被低估了。在植入柔性瓣环后,瓣环的稳定性在这种解剖条件以及后来的动态条件下可能不够。因此,2005 年的二尖瓣置换术才应该是更合适的手术。
除手术外,单肺患者的围手术期管理也具有挑战性。术前,心脏位置的改变会给标准的诊断检查造成困难。在本病例中,等效的心尖超声心动图切面是在左侧椎旁位置获得的。对于术前评估,肺活量、1 秒钟用力呼气量和肺部一氧化碳弥散量可能是确定患者是否适合心脏手术的合适标准。由于病例较少,迄今为止尚未公布标准值。此外,肺切除术后肺容量会减少,通常会出现限制性通气障碍。与此相反,剩余的肺部会过度充气。手术期间,必须相应调整机械通气设置。术后,任何通气功能障碍(如肺炎)都可能成为危及生命的并发症。此外,在本病例中,随着时间的推移,患者明显对标准预防药物产生了抗生素耐药性并导致了心内膜炎,并影响到二尖瓣生物瓣膜。因此,应考虑抗生素耐药性的可能性,以避免类似患者出现此类并发症。
总之,本病例强调了即使在复杂的情况下,肺切除术(和重复手术)后的心脏瓣膜手术也是可行的。如果患者患有相关的心脏瓣膜疾病,又没有其他治疗方法,那么手术可能会使患者受益。然而,目前仅有少数相关研究发表。需要更多的数据来制定标准化方法,为这些患者确定适当的治疗策略。
文献评价
文章报道了一个罕见且复杂的病例:一位患者在50年前接受肺切除术后,因心脏瓣膜疾病三次接受心脏瓣膜手术。这种长期的随访和多次手术的情况在临床上较为罕见,因此具有一定的创新性和临床参考价值。尽管文章提供了详细的手术和治疗过程,但对于患者术后的长期生活质量和生存率的详细数据较少,这限制了对手术效果的全面评估。
这篇文章提供了一个详细的病例报告,涵盖了从病史、诊断、治疗到术后管理的全过程,对临床实践具有积极的指导意义。
本期中文解读
郑子龙
/初稿
范成铭
/校审
范成铭,博士
The Thoracic and Cardiovascular Surgeon 编委
中南大学湘雅二医院
外科学博士,药学博士后,副研究员,博士研究生导师,中南大学湘雅二医院心血管外科主治医师,中华志愿者协会中西医结合专家志愿者委员会心外科专业组常务委员,中国研究型医院学会心脏瓣膜病专业委员会青年委员,湖南省医学会胸心血管外科学专业委员会青年委员,美国阿拉巴马大学伯明翰分校生物医学工程学系国家公派联合培养博士,中南大学十佳大学生、中南大学湘雅二医院青年岗位能手、十佳青年、湖南省卫生健康高层次人才,中南大学“升华学者计划”优秀青年人才。美国胸外科协会(AATS) Evarts A. Graham Memorial Traveling Fellowship 2023年获得者(首位获得该奖项的国内心外科医生,每年仅资助一名心外科医师)。美国Samuel and Jean Frankel心血管中心Fellow。荷兰Catharina医院心胸外科Fellow,比利时Cliniques universitaires Saint-Luc医院心胸血管外科Fellow。主持国家自然科学基金2项、湖南省优秀青年科研基金、湖南省优秀博士后基金各1项,先后获省优秀博士研究生学位论文奖、湖南省医学科技一等奖2项,科技进步二等奖1项,医学十大临床创新技术奖1项。主要研究方向为缺血性心脏病的细胞相关治疗研究,以第一或通讯作者身份在国内外学术期刊发表学术论文30余篇,现担任SCI期刊:Journal of the Renin-Angiotensin-Aldosterone System主编、Clinical and Experimental Hypertension主编,Journal of Cardiothoracic Surgery、BMC Bioinformatics副主编,Clinical Case Reports高级主编,European Journal of Medical Research副主编及心脏病学栏目主编,BioMed Research International、PLoS ONE、PeerJ学术主编,BMC Medicine、Reviews in Cardiovascular Medicine、Thoracic and Cardiovascular Surgeon、BMC Cardiovascular Disorders等多本SCI杂志编委。
The Thoracic and Cardiovascular Surgeon Reports (TCS Reports) 为开放获取期刊,出版与胸部和心血管研究具有重要临床相关性的病例报告,特别强调手术介入措施。TCS Reports 欢迎麻醉、心脏病学、生理学和病理学等胸外科和重症监护领域的投稿。
目标与范围
交流有关心脏、血管和胸部手术治疗的特殊或异常病例
报告胸部、血管和心血管手术中治疗管理的临床新方法
记录可能表明对现有疾病病因与发病机制有的新的或替代性理解的特定临床发现
对发表在母刊The Thoracic and Cardiovascular Surgeon上的研究成果和综述进行补充
促进与胸心血管外科护理相关专业和子专业之间更广泛的信息交流
在TCS Reports上的所有投稿均经过严格的同行盲评。鼓励提交图像和视频等补充资料。
