
新型冠状病毒疫情持续发酵中,随着确诊人数的不断增加,公众对特效药的期望也更加殷切。相应地,各媒体对可能的有效药的报道也层出不穷。
2月4日,李兰娟院士宣布了两种可能有效的药:阿比朵尔和达芦那韦。美国的新药瑞得西韦也开始在我国测试,这无疑增加了大众的信心。那么距离新冠病毒特效药的商业化生产到底还要多久呢?现简单梳理一下新药研发的基本流程,对新药的可能商业生产日期作个大概推测。
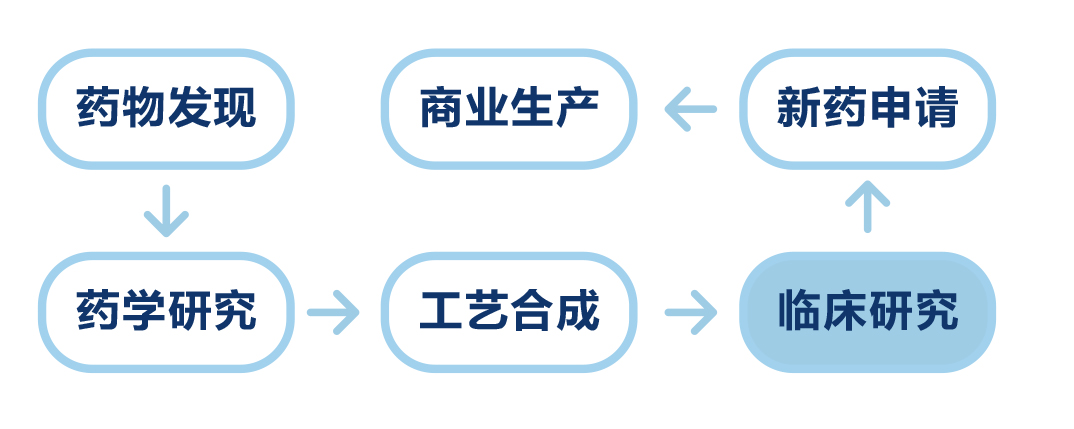
新药研发是一项投资高、周期长的大工程,其过程自然不是直接从药物发现就能一步直接到商业生产。药物研发一般分为六个阶段:①药物发现及前期研究,②临床前药学研究,③工艺合成,④临床试验,⑤新药申请,⑥商业化生产。
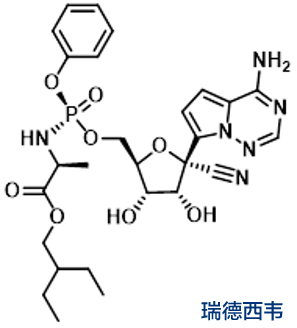
目前最广为人知也是被最寄予希望的是吉利德公司的新药瑞德西韦。美国首位患者在住院的第六天病情危急,医生决定为其提供试验用药物瑞德西韦,第七天晚上,该患者接受了瑞德西韦的静脉输注,第八天,这名患者的临床症状出现了立竿见影的改善。目前其药物结构已开源,一代和二代的合成路线也被公布。
但是瑞德西韦是实验性药物,目前处于临床研究阶段,尚未上市。那么,新药上市前临床研究到底需要多久呢?
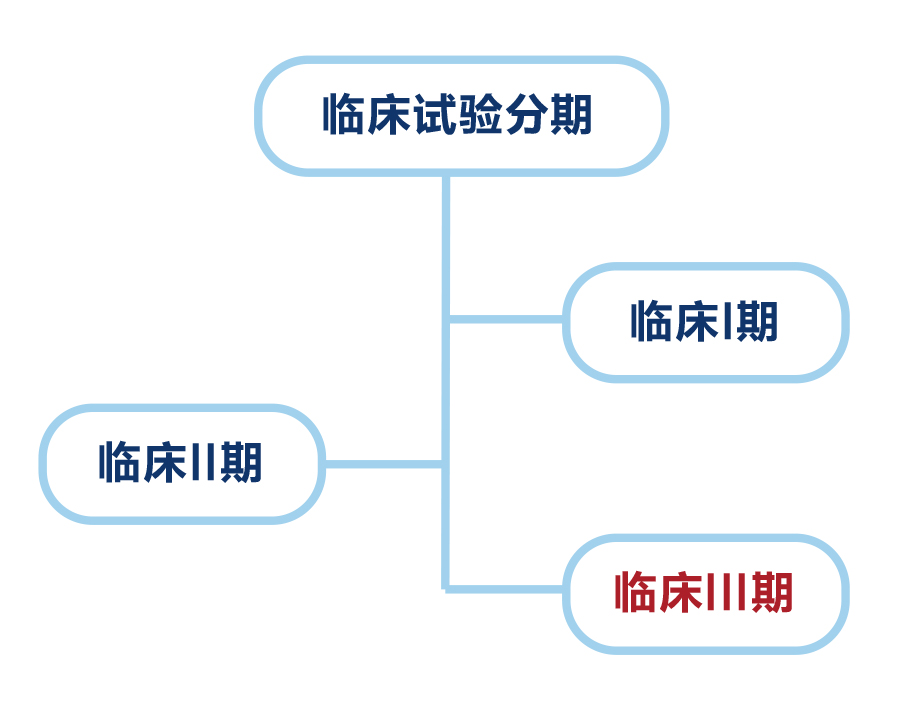
新药上市前的临床研究包括三个阶段,即首次试用于人类(健康受试者)的I期临床研究,试用于少数患者的II期临床研究,有上千患者参加的III期扩大临床研究。
据悉,我国将启动的临床试验是 III 期、随机、双盲、安慰剂对照试验,旨在确定使用瑞德西韦治疗 2019-nCoV 的安全性和有效性。试验由中日友好医院曹彬教授牵头,2月3日开始,预计4月27日结束。
如果临床数据能够成功证明药物的安全性和有效性,将可向FDA提出新药申请(NDA)。新药申请必须包括所掌握的一切相关科学信息,典型的新药申请有10万页甚至更多。根据法律,FDA审核一份NDA的时限应该为180日。但是几乎所有案例中的新药申请从首次提交到最终获得FDA批准的过程都超过了这个时限。
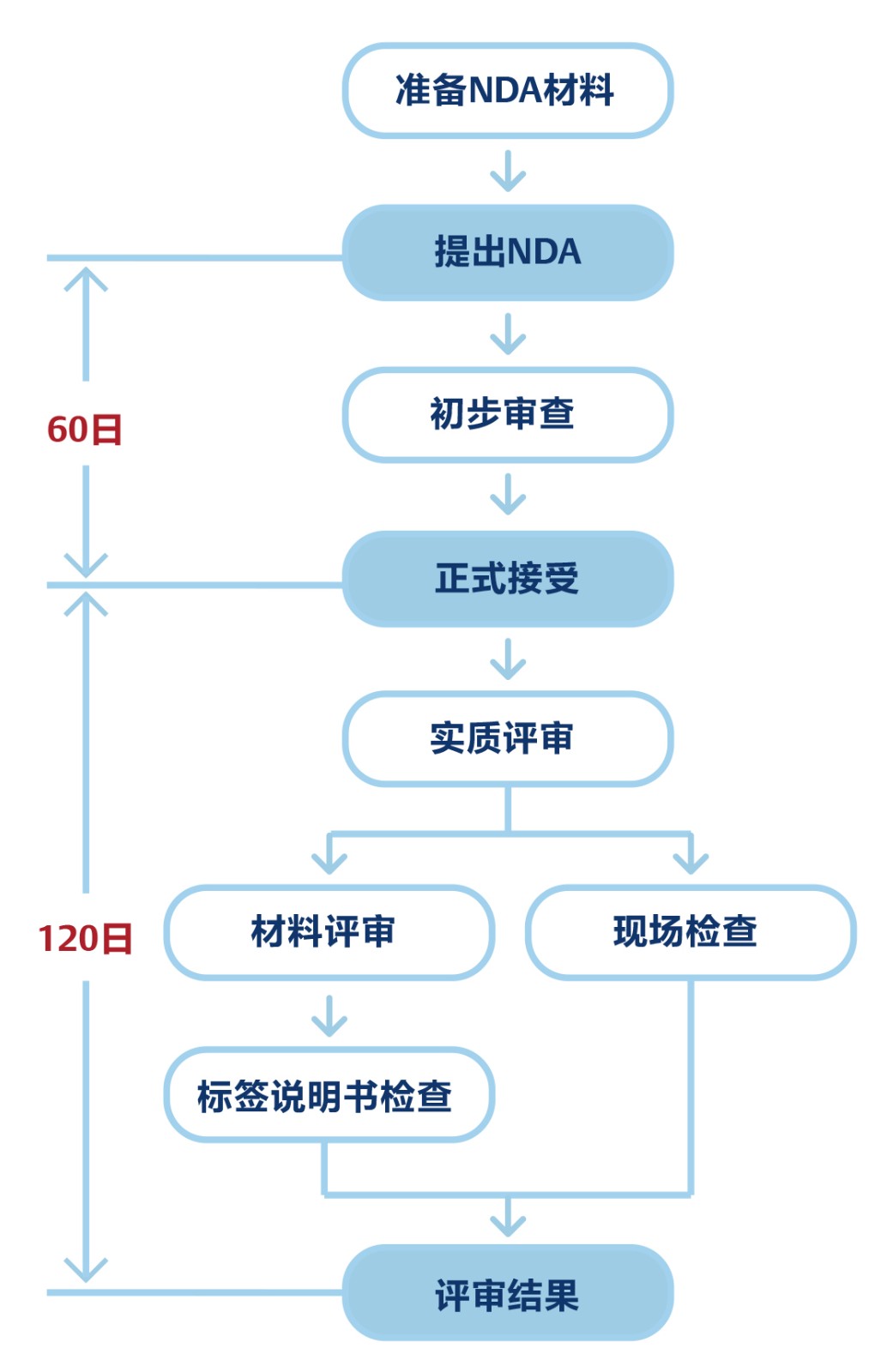
一旦FDA批准新药申请后,该药物即可正式上市销售,供医生和病人选择使用。若瑞德西韦III期临床能够证明安全有效,入夏前有希望将此特效药用于新冠肺炎的治疗。值此特殊时期正需要“中国速度”来快速控制疫情!
希望公众做好自我防护,不轻信谣言,停止盲目焦虑,相信中国的科研人员在此“战疫”中可以交出让大家满意的答卷。
*本文为林同学独家供稿。

