

Synthesis of Natural Products and Potential Drugs
Total Synthesis of (+)-1,2-Dehydroaspidospermidine, (+)-Condyfoline, and (–)-Tubifoline
Contributors: Erick M. Carreira, Manuel Freis
Delayre B, Piemontesi C, Wang Q, Zhu J. * École Polytechnique Fédérale de Lausanne, Switzerland
Angew. Chem. Int. Ed. 2020;
DOI: 10.1002/anie.202005380.
原文解读
单萜吲哚生物碱(monoterpene indole alkaloids, MIAs)是一类重要的天然产物,因其生物活性和复杂结构而得到合成化学家的广泛关注。基于前期对于2,3-二取代吲哚类化合物的合成研究,作者提出了如下的设计(图1)以合成2,2,3-三取代吲哚啉类化合物。硝基在三氯化钛的作用下被还原为亚硝基,之后发生分子内电环化反应,再发生烷基迁移,最后再被三氯化钛还原得到吲哚啉类结构。
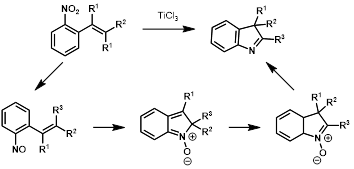
图1. 三氯化钛介导合成2,2,3-三取代吲哚类化合物
为了验证反应设计的合理性及应用价值,作者决定利用这一方法合成三个具有2,3,3-三取代吲哚啉骨架的天然产物分子。
作者首先利用这一方法完成了(+)-1,2-dehydroaspidospermidine分子的全合成(图2)。这一合成从简单的不饱和酮衍生物1出发,经不对称加成及相关衍生化后得到化合物2,再通过脱羰基化偶联,顺利得到化合物4。需要说明的是,这一步偶联的立体选择性并不是很好。但是新生成的手性中心在之后反应的步骤中会被消除(化合物7),因此不会对最终结果造成影响。
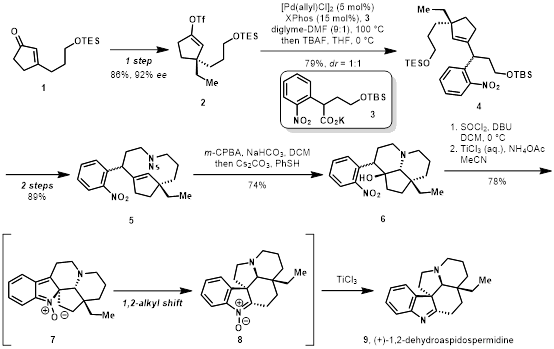
图 2 | (+)-1,2-dehydroaspidospermidine的全合成
化合物4经过官能团转换及Mitsunobu反应后得到化合物5,在脱去Ns保护基(对硝基苯环酰基)之后发生一个环氧化-开环反应,得到化合物6。由于大环构象导致的空间位阻,这一反应的立体化学是高度可控的。之后在二氯亚砜和碱的的作用下脱水,形成所需的四取代双键。之后进行三氯化钛介导的吲哚啉合成反应,顺利地得到了目标产物9,合计共六步。
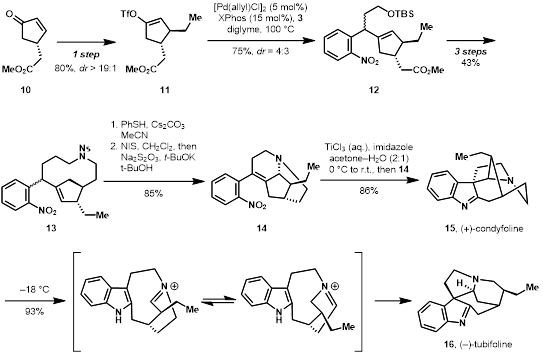
作者随后着手进行另外两个天然产物的合成,所采用的合成策略与(+)-1,2-dehydroaspidospermidine的合成策略相似。化合物10经不对称加成及烯醇醚化后转化为化合物11,之后经类似的脱羰基化偶联反应得到化合物12,再经转化得到化合物13。之后在硫酚作用下脱去Ns保护基,产物与NIS作用生成碘鎓离子,被分子内的二级胺进攻,再在碱的作用下消除得到化合物14。同样的,这一转化的立体选择性由分子自身的大环构象控制,并消去了苯环α位的手性中心,得到了进行三氯化钛转化所需的四取代双键。之后在三氯化钛的作用下顺利合成了(+)-condyfoline分子,合计七步;而这一分子在低温下可自发转化为(–)-tubifoline分子,反应经由一个retro-Mannich/Mannich历程,共八步。
总结与评述
Jieping Zhu教授课题组报导了一种全新的2,3,3-三取代吲哚啉合成法,并完成了三个相关天然产物分子的全合成。相比之前已报道的工作中所应用的方法,如Harley-Mason和Kaplan在对(±)-aspidospermidine的仿生合成中采用的强酸催化的吲哚骨架重排,这一方法反应条件更温和,因而具有更好的立体选择性,不会出现反应过程中手性中心的消旋以及立体化学的丢失。
Zhu教授的这一工作,为许多2,3,3-三取代吲哚啉的合成都将带来的新的思路,在对于这一类天然产物的生源合成有异曲同工之妙。在这一工作中,三个天然产物的合成路线都十分简洁,路线设计较好,均控制在了十步以内。立体化学上也做了巧妙的设计,整个合成在不使用复杂手性配体的前提下实现了较好的手性控制,是一篇很不错的工作。全文也包含了对于反应机理的思考、验证和讨论,值得一读。
现如今,方法学驱动的全合成已经越来越受到合成化学家的青睐。近年来可以看到很多十步左右的天然产物全合成工作得到发表,比如基于去芳香化反应的天然产物合成以及近年来兴起的化学酶法合成等。这些工作大多依赖于精心设计的反应体系,通过新方法快速构建传统化学方法无法有效合成的结构,大大缩短反应步骤。这些工作在一定程度上也反映出天然产物全合成研究简洁化的趋势。通过发展新方法以提高合成效率,同时以复杂分子的合成验证方法的价值。

微信扫描二维码,阅读原文
本文推荐解读 BY 武汉大学张旌扬
SYNFACTS
阅读SYNFACTS更多论文,请点击:https://www.thieme-connect.com/products/ejournals/html/10.1055/s-0040-1707081
