

作者: 李儒
中科院上海有机所
✦ +
+
Barry M. Trost
介绍

Barry M. Trost [巴里·马丁·特罗斯特]
美国科学院院士,美国艺术与科学院院士。
1941年6月13日出生于美国宾夕法尼亚州费城。1962年获宾夕法尼亚大学学士学位,1965年获麻省理工学院博士学位(导师:Herbert O. House教授),1965年-1982年担任威斯康星大学麦迪逊分校教授,1987年任斯坦福大学化学系教授,1990年至今担任斯坦福大学化学系Tamaki人文科学教授。
他的研究兴趣涵盖有机化学各领域,对现代有机合成和绿色化学贡献卓著。诸多广为应用的化学反应,如Trost 不对称烯丙基烷基化反应、Tsuji-Trost 反应和Trost 配体等,均以其名字命名。他首次提出原子经济性概念,并于1998年荣获“美国总统绿色化学挑战奖”。
迄今,Trost教授已在Nature, Science等国际著名期刊上发表科学论文950多篇,主编了包括《综合有机合成》在内的10余本专业著作。
✦ +
+
研究兴趣
Trost的研究重点是开发新的合成反应和试剂,主要用于从容易获得和简单的起始材料合成复杂分子。他倾向于利用过渡金属开发“' chemists' enzymes”——基于非肽过渡金属的催化剂,进行化学、区域、非对映,尤其是对映选择性反应。此过程中,必须注意原子经济问题[2],尽量减少能源和原材料的消耗。
钯催化剂是Trost团队的主要研究方向,同时使用镍、铬、钼、钌、铁和钨络合物以及由两种不同金属组成的双金属络合物可能形成选择性互补的产物。主要关注的是 1) 探索具有新型反应性的金属的不寻常氧化态,以及 2) 产生对映体纯立体中心的不对称模型。
除此之外,Trost对主族元素的化学也特别感兴趣,他认为主族化学,特别是涉及硅、锡和硫的化学为新的反应设计提供了机会。例如,含硫底物根据所处化学环境可以作为亲电试剂或亲核试剂——这种双重性使它们被称为“化学变色龙”,用于不对称直接羟醛缩合的新型催化剂的合理设计是一个令人兴奋的推动力。
迄今为止,Trost团队利用这些新的合成工具发展出一系列针对复杂天然产物的新合成策略,其中包括β-内酰胺类抗生素、离子载体、类固醇和相关化合物(例如维生素D代谢物)、生物碱、核苷、碳水化合物以及大环内酯类、萜类和四环类抗肿瘤和抗生素药物等靶点的合成。
✦ +
+
研究成果
1, 钯催化的不对称烯丙基烷基化反应(Tsuji-Trost反应)
Tsuji-Trost反应作为一类重要的对映选择性地构筑碳碳键和碳杂键的方法,广泛应用于手性骨架分子的合成,在有机合成化学领域取得了长足发展。为提高反应活性和区域选择性,通常需要在烯丙基试剂上事先引入易离去基团,如碳酸酯、卤素等。相比之下,直接不对称烯丙基碳氢键官能团化反应可以从廉价易得的简单烯烃出发,具有更高的原子经济性和合成经济性,越来越受到化学工作者的关注。
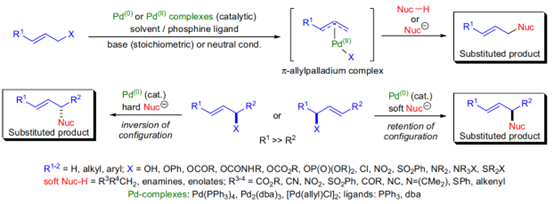
图 1:钯催化的不对称烯丙基烷基化反应
(Tsuji-Trost反应)
该反应涉及常见的烯丙基钯中间体作为亲电试剂,使用合适的碳亲核试剂和π-烯丙基前体,可在亲核试剂和亲电试剂两侧构建季碳立体中心。
Trost于2006年发表在Synthesis中的一篇综述中大致总结了其应用(DOI: 10.1055/s-2006-926302)[3],例如从烯丙基化产物实现了Benzomorphans的不对称合成(图2,在亲核位点构建四元立体中心)[4]以及环戊霉素(viridenomycin)环戊基核心的不对称合成(图3,在亲电位点构建四元立体中心)[5]等。
而后在2019年发表于Synthesis的一篇文献中汇总了钯催化非环四取代立体中心的不对称烯丙基烷基化合成策略[6](DOI: 10.1055/s-0037-1610386)。
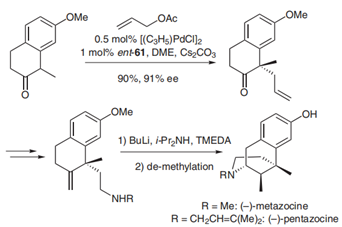
图 2:Benzomorphans的不对称合成
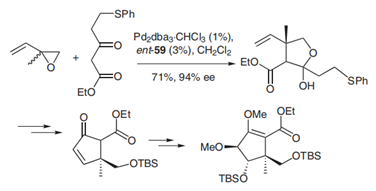
图 3:环戊霉素(viridenomycin)的不对称合成
2, 钯催化的环异构化反应
完全原子经济下发生的转化最大限度地减少了原材料的利用,并且不产生废物,代表了合成效率的上限。过渡金属催化的环异构化反应代表了一类主要的原子经济反应,Trost团队于1998年发表于Synlett期刊上一篇文献中总结了常见的过渡金属催化的环异构化反应(DOI: 10.1055/s-1998-1557)[7]。
早在1993年,Trost课题组就已经报道了钯催化的多烯环异构化反应,该反应可以构筑6个新的C-C键和7个环并且兼容含氧官能团。与相关的分子内Heck反应相比,该反应显示很高的原子经济性和步骤经济性。然而,由于缺乏合适的合成策略,因此它的潜力一直被低估也没有应用在天然产物的合成上。

图 4:pd催化多烯炔环异构化是一种合成萜烯的潜在工具
近年来,Trost课题组通过改变萜类化合物两相生源合成途径的顺序(首先,将氧化酶相前置,因为在复杂体系上进行后期氧化是比较困难的,后者往往需要冗余的氧化还原操作;其次,预先构筑的手性含氧官能团也便于后面环化酶相的C-C键构筑,同时也有利于立体化学的控制),简化了萜类化合物的合成步骤,从炔丙醇出发,仅需5-8步便可高效地完成四个倍半萜的全合成[8],相关结果发表在Nature Chemistry上。
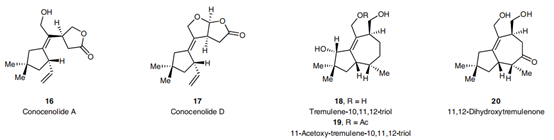
图 5:萜类化合物合成实例
3, 其他Trost反应
在Trost教授80岁寿诞之际,加州大学伯克利分校的F. Dean Toste教授(Trost教授所授学生之一)系统地总结了Barry M. Trost教授迄今为止所发展的在全合成中已经获得广泛应用但是并未冠以“Trost反应”的9个有机反应,分别包括二级醇及醛基的氧化反应、硫醚到砜的氧化反应、Trost脱氢氧化反应、Trost硅氢化反应、Trost砜的还原反应、Trost炔烃–烯烃偶联反应、Trost炔烃–炔烃偶联反应、三苯基磷促进的炔基酯异构化反应、Trost γ-加成和α-加成。相关内容于2021年以“综述”形式发表在Israel Journal of Chemistry期刊上(DOI: 10.1002/ijch.202000103)[9]。
参考文献:
[1] G. Molander, Preface – “The Power of Transition Metals: An Unending Well-Spring of New Reactivity”in honor of Prof. Barry Trost and 20 Years of the Thieme reference work Science of Synthesis, Synlett 2021, 05, 32.
[2] a) B. M. Trost, The Atom Economy—A Search for Synthetic Efficiency, Science, 1991, 254, 1471.
b) B. M. Trost, Angew. Chem. Int. Ed. Engl. 1995, 34, 259.
[3] C. Jiang, B. M. Trost, Catalytic Enantioselective Construction of All-Carbon Quaternary Stereocenters, Synthesis 2006, 3, 369.
[4] B. M. Trost, W. Tang, J. Am. Chem. Soc. 2003, 125, 8744.
[5] B. M. Trost, C. Jiang, Org. Lett. 2003, 5, 1563.
[6] B. M. Trost, J. E. Schultz, Synthesis 2019, 51, 1–30.
[7] B. M. Trost, M. J. Krische, Synlett 1998, 1, 1-16.
[8] B. M. Trost, C. Min, Nature Chemistry, 2020, 12, 568–573.
[9] J. S. Tracy, C. A. Kalnmals, F. D. Toste, Isr. J. Chem. 2021, 61, 340–366.
扩展阅读
