
#Thieme未来星计划荣誉推出神经外科专题,我们将与未来星计划的小伙伴们持续推荐解读与神经外科学相关的论文与研究,欢迎关注。同时,欢迎感兴趣的小伙伴加入我们。
本期推荐 & 解读 BY
亚东 | 首都医科大学
↓ 神经外科专题丨36
前庭神经鞘瘤(VS)是桥小脑角区最常见的肿瘤之一,占该区域所有肿瘤的85%,起源于前庭神经的施万细胞。当肿瘤大于1cm时,通常会引起症状,最常见的是前庭神经功能障碍,包括听力丧失、眩晕和面部麻木,面部表情肌无力是与面神经受累相关的晚期症状。随着磁共振成像(MRI)的发展,近年来VS的诊断有所增加,尤其是早期病变。但是,在许多国家和美国的三级医院,经常会遇到大体积VS,出现显著的占位效应。对于症状严重的Koos IV级VS,由于立体定向放射治疗(SRS)无法缓解肿瘤占位效应,甚至可能暂时加重瘤周水肿,所以显微手术切除通常优于临床观察或SRS。但晚期VS复杂,手术无法全切,肿瘤残留的发生率明显更高。次全切除或近全切除后肿瘤残留通常是SRS的适应症,通常规定边缘剂量为12-13 Gy。然而,SRS局部控制率似乎很差,最近的一项前瞻性研究表明,在次全和近全切除术后辅助放射治疗后,局部控制率仅为64%。尽管生长较快的肿瘤通常对放射治疗更敏感,但由于桥小脑角肿瘤复发快速增长可能会造成周围神经侵袭,由于标准剂量SRS后肿瘤复发可能很难通过再次手术切除或重复SRS来治疗,因此可以考虑增加次全切除后SRS的照射剂量。此研究的目的是比较近全切除或次全切除后生物有效剂量(BED)递增SRS和标准剂量SRS相关的局部控制率和神经毒性反应差异。
J Neurol Surg B Skull Base 2021; 82(S 03): e9-e14
DOI: 10.1055/s-0040-1712462
Original Article
Khattab et al.
结果
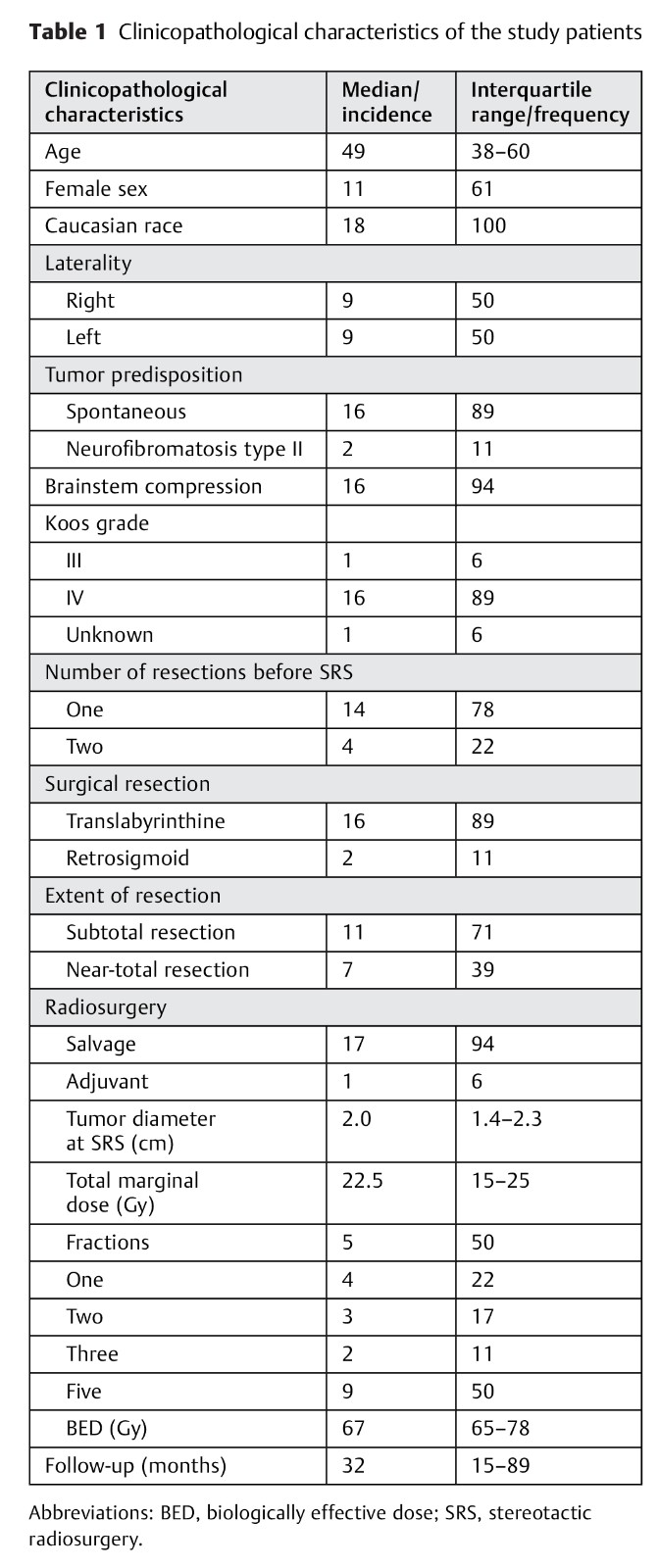
表1:研究患者的临床特征
讨论
这项研究描述了VS患者在近全切除或次全切除后接受SRS治疗的临床结果。剂量递增队列的局部控制率为100%,而标准剂量对照组的局部控制率为91%。本系列是所知的第一个研究剂量递增SRS治疗残余治疗进展的研究,可能代表一种更具侵袭性的VS亚群。这一亚群表现为体积更大、占位效应更明显和症状表现更多样,可能在肿瘤次全切出术后具有更抢的抗辐射性。此研究中的VS体积较大,具有明显的占位效应和瘤周水肿。这些特征可能是侵袭性的临床预测因子。Koos IV级VS都有脑干受压表现,需要立即手术减压。此研究中,Koos III级在干预前被发现,显示出异常快速的生长速度,快速生长速度的自然病史也可能是肿瘤生物学行为的预测因子。但是,无论Koos分级如何,所有病例都需要进行次全或近全切除并保留颅神经结构和功能的完整性。
VS的次全切除和SRS极具争议。对于晚期肿瘤,一些中心主张术前多学科规划,即术前决定进行次全切除,然后进行术后SRS。这些研究认为,因为次全切术术中对于面神经的牵拉和损伤程度较低以及照射体积最小,与全切术相比,次全切除术加辅助放疗可改善面神经功能。但是,其他研究反对这种方法,并建议仅在术中根据肿瘤质地和生长侵袭情况作出次全切除的决定,以最大限度地提高肿瘤全切除的可能性。根据这一论点,在术中决定进行次全切除的情况下,需要进行术后随访和推迟SRS,而非术后即刻的辅助SRS。因为并非所有残余肿瘤都会进展,当出现残留肿瘤复发情况时,SRS也可有效挽救肿瘤进展。
与标准剂量SRS相比,递增剂量SRS具有明显的局部控制优势,但对于这种方法的潜在短期毒性存在不确定性。在此研究中,28%的患者出现早期或晚期神经系统后遗症,其中60%在剂量递增队列中,而标准剂量队列中为40%。永久性神经系统后遗症的发生率为6%,除一例外,所有观察到的神经系统后遗症都是暂时的。因此,术后短期的神经系统后遗症可能是由于SRS术后短暂的瘤周水肿,加上手术切除过程中对面神经的侵扰,导致面神经更加纤细,对SRS诱发的瘤周水肿更敏感。地塞米松改善面神经功能的证据高度提示了这种可能,而并非对面神经的直接辐射损伤。
临床建议
剂量递增的SRS对次全或近全切除后复发与进展的局部控制率较标准剂量SRS更高,并且似乎没有更加显著的放射后神经系统后遗症。但仍需要进行更大规模的临床研究。
阅读本刊更多论文,请点击这里。
